
| chercheursduvrai.fr |
 Aide Aide
 Recherche Recherche
 Membres Membres
 Calendrier Calendrier
|
| Bienvenue invité ( Connexion (Log In) | Inscription (Register) ) | Recevoir à nouveau l'email de validation |

 To view this board in english, you must be registered.
To view this board in english, you must be registered.| Pages: (3) 1 [2] 3 ( Aller vers premier message non lu ) |    |
|
Ecrit le: Samedi 16 Mars 2013 à 10h22

|
|||
 Expert(e)       Groupe: Membres Messages: 2064 Membre n°: 275 Inscrit le: 11/06/2007 |
Peut-être que la batterie a été décalottée. Cinq éléments ont été transformé en électrolyseurs. Le sixième conservé pour fournir la tension puisque 0,37V suffit. ** Euh! Je me demandais de l'utilité du borax dans le dernier filtre ? Retenir l'ammoniac ? ou autre ? Je m'en sers comme flux pour la brasure, et comme biocide. Il sert aussi comme fondant dans l'industrie du verre, de retardateur de flamme, de capteur de neutrons, aussi dans la fracturation hydraulique... Il y a une réponse là:
http://lesmoutonsenrages.fr/2012/11/14/4-j...ionne-a-lurine/ Bof ? http://www.google.com/patents/EP0739635A1?cl=fr |
||
|
Ecrit le: Samedi 16 Mars 2013 à 12h27

|
|
 Expert(e)       Groupe: Membres Messages: 108 Membre n°: 10216 Inscrit le: 25/11/2012 |
Je me demande si dans une bonne thermos capable de bien tenir le coup, une quantité d'énergie nécessaire pour électrolyser ne pourrait pas être amoindrie ?
|
|
Ecrit le: Samedi 16 Mars 2013 à 15h17

|
|
|
Expert(e)       Groupe: Membres Messages: 238 Membre n°: 10183 Inscrit le: 11/10/2012 |
je suis pas chimiste pour un rond mais je me demande si il n'y a pas une reaction au niveau du bocal de borax genre pantone!
(Na2B4O7•10H2O).formule chimique du borax apparement l'electrolyse d'urine produit de l'ozone aussi et ils pretendent injecter de l'hydrogene pur donc c'est bien que l'ozone est retenu et a part avec le borax je vois pas avec quoi! Du coup est-ce qui il n'y aurais pas un echange qui se produirait avec le borax qui viendrait booster en hydrogene? mais je dis ca comme je ne mis connait pas avis aux connaisseurs |
|
Ecrit le: Samedi 16 Mars 2013 à 15h58

|
|||
 Expert(e)       Groupe: Membres Messages: 3069 Membre n°: 10219 Inscrit le: 30/11/2012 |
Tu l'as où ton borax, parce que en Europe c'est difficile à obtenir maintenant ? -------------------- Supplions inlassablement Dieu d’accroître en nous deux vertus : l’amour et la crainte. Car l’amour nous fera courir sur les voies du Seigneur et la crainte nous incitera à regarder où nous posons le pied. L’un nous fera apprécier les réalités du monde pour ce qu’elles sont véritablement, l’autre nous mettra en garde contre toute négligence. Padre PIO |
||
|
Ecrit le: Samedi 16 Mars 2013 à 16h25

|
|||
|
Expert(e)       Groupe: Membres Messages: 502 Membre n°: 10213 Inscrit le: 25/11/2012 |
Bien vu. Oui elle me semble décalottée, et effectivement elles ont du garder une cellule On avance, on avance Le borax est appelé borate de sodium en france et est vendu en pharmacie! |
||
|
Ecrit le: Samedi 16 Mars 2013 à 16h51

|
|
 Expert(e)       Groupe: Membres Messages: 2064 Membre n°: 275 Inscrit le: 11/06/2007 |
Acheté là :
http://www.droguerie-jary.com/ Mais j’ai du être le dernier client… Sinon, il y en a là, mais faut appeler un n° ( ?) => http://www.mon-droguiste.com/borax-borate-...fm#.UUSOOxeQWfU Ok! Lire jusqu'à la fin. C'est réglementé... sur Ybaisse, il y a de quoi faire… 100, 250, 500, 1000, 2000 gr http://www.ebay.fr/sch/i.html?_trksid=p519...cat=0&_from=R40 Pour ceusses qui cherchaient du K2CO3 (CFR) http://www.mon-droguiste.com/carbonate-pot...fm#.UUSSRReQWfU http://www.ebay.fr/sch/i.html?_nkw=+K2CO3&...cat=0&_from=R40 |
|
Ecrit le: Samedi 16 Mars 2013 à 18h47

|
|
|
Expert(e)       Groupe: Membres Messages: 460 Membre n°: 283 Inscrit le: 12/06/2007 |
Bonjour à tous.
Je pense que qu’ elles utilisent une vielle batterie. Donc... j’en ai retourné une pour la vider et ce qui en sort est d’un rouge marron ! J’ai essayé de la rincer à plusieurs reprises, c’est très difficile à nettoyer, et ça sort toujours de la même couleur. Je ne vous cache pas que le but de mon nettoyage est de refaire une telle expérience. J’ai fait un collecteur sur les bouchons de tous les éléments. Le silicone sèche ! Il se trouve que j’ai de l’engrais sous forme liquide qui titre à 39 % de N, qui est composé de 50 % d’Urée (CO (NH2)2), 25 % d’Ammonium (NH4+), et 25 % de Nitrate (No3-). Je pense faire une solution à 8 % pour retrouver le taux d’urée de l’urine. On verra demain, mais je pense que ma vielle batterie est trop oxydée, et que ça na ne donnera rien. À+. |
|
Ecrit le: Dimanche 17 Mars 2013 à 09h35

|
|
|
Expert(e)       Groupe: Membres Messages: 502 Membre n°: 10213 Inscrit le: 25/11/2012 |
Utilise une alim de pc a la place de ta vieille batterie. Pour l'électrolyse ca marche super bien, tu tires du 20 ou 30A facile selon le modele, et en 12v ou 3v, il faut chunter le fils vert et la masse (noir) pour la démarrer.
|
|
Ecrit le: Dimanche 17 Mars 2013 à 10h37

|
|
|
Expert(e)       Groupe: Membres Messages: 460 Membre n°: 283 Inscrit le: 12/06/2007 |
Bonjour, à tous.
Ce que je pense avoir compris, c’est que la batterie sert d’électrolyseur et pas de source d’énergie ! Je prévois de brancher un chargeur de batterie sur ladite batterie et de voir ce qui se passe. À plus tard si tout va bien. |
|
Ecrit le: Dimanche 17 Mars 2013 à 11h46

|
|
 Expert(e)       Groupe: Membres Messages: 3069 Membre n°: 10219 Inscrit le: 30/11/2012 |
Oui le borax est reglementé en europe, considéré comme nocif ...
Faite tout çà dehors à l'air libre... PS: pour convertir une ancienne batterie : voir bedini -------------------- Supplions inlassablement Dieu d’accroître en nous deux vertus : l’amour et la crainte. Car l’amour nous fera courir sur les voies du Seigneur et la crainte nous incitera à regarder où nous posons le pied. L’un nous fera apprécier les réalités du monde pour ce qu’elles sont véritablement, l’autre nous mettra en garde contre toute négligence. Padre PIO |
|
Ecrit le: Dimanche 17 Mars 2013 à 13h54

|
|
|
Expert(e)       Groupe: Membres Messages: 502 Membre n°: 10213 Inscrit le: 25/11/2012 |
Borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, Borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, Borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie, borate de soude en pharmacie...
|
|
Ecrit le: Dimanche 17 Mars 2013 à 16h12

|
|
|
Expert(e)       Groupe: Membres Messages: 460 Membre n°: 283 Inscrit le: 12/06/2007 |
Comme prévu la batterie ne donne rien !
En revanche j'ai réussi à fait quelques tests. Le taux de concentration est le même que pour la batterie ; 8 % d'engrais soit 2% d'urée. A+ |
|
Ecrit le: Dimanche 17 Mars 2013 à 18h19

|
|
|
Expert(e)       Groupe: Membres Messages: 323 Membre n°: 10284 Inscrit le: 02/02/2013 |
Sinon voici la composition de l urine :
http://scienceblogs.com/startswithabang/fi...ne-contents.jpg 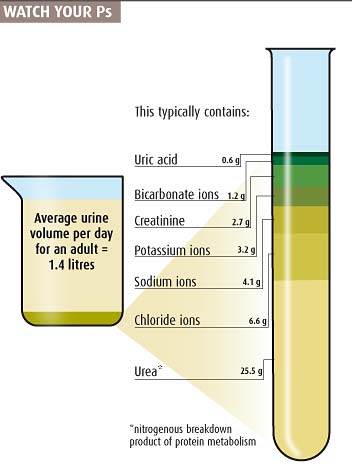 Trouvé ici : http://scienceblogs.com/startswithabang/20...ow-in-your-uri/ SG |
|
Ecrit le: Lundi 18 Mars 2013 à 23h47

|
|
|
Expert(e)       Groupe: Membres Messages: 460 Membre n°: 283 Inscrit le: 12/06/2007 |
Bonsoir à tous
Ce soir j’ai bricolé une petite cellule pour faire des tests de débits.  J’ai adopté la méthode de Chercheur, qui est simple à mettre en œuvre et efficace En conclusion je n’ai pas trouvé de différence, avec ou sans urée le débit de HHO est le même. A la fin du test… Je n’ai pas pu résister, j’ai allumé la bouteille, elle est partie très vite en sifflant très fort !!!! J’adore ce test, je pense que je vais en faire plein d’autres. A+ |
|
Ecrit le: Mardi 19 Mars 2013 à 16h20

|
|
|
Expert(e)       Groupe: Membres Messages: 460 Membre n°: 283 Inscrit le: 12/06/2007 |
Bonjour à tous.
Après avoir testé le fonctionnement de mon petit électrolyseur bricolé, j’ai franchi le pas. Puisque c’est le titre du post il fallait bien en finir avec cette info. Le test ultime, la couleur du liquide dans le bocal ne laisse aucun doute sur son origine ! La vidéo parle d’elle-même. C’est juste immonde, C’est encore le bicarbonate de soude qui a la meilleure efficacité. À+. |
|
Ecrit le: Mardi 19 Mars 2013 à 19h04

|
|
|
Expert(e)       Groupe: Membres Messages: 238 Membre n°: 10183 Inscrit le: 11/10/2012 |
pour le coup cisco l'avantage c'est qu'avec l'urine on a besoin que de O,37v contre 1.23 pour l'eau ce qu'il faut pour avoir une mesure tangible c'est se procurer une pwm "regulateur de tension" et n'injecter en courant que ce qu'il faut et en tirer des mesures mais il faut aussi que ton electrode soit composer de nickel "je ne sais pas si il faut que les deux electrodes le soit"
et pour le coté repugnant ce n'est qu'un cliché je ne pense pas que tu aie peur de mettre un doigt dans l'essence et pourtant je ne trouve pas sa bien plus propre. mais on peut aussi travailler avec des gants pour ma part j'attend d'avoir le matos qu 'il faut et je mis remet pour le moment je profite un peu du soleil qui pointe le bout de son nez bye |
|
Ecrit le: Jeudi 21 Mars 2013 à 16h54

|
|
|
Expert(e)       Groupe: Membres Messages: 323 Membre n°: 10284 Inscrit le: 02/02/2013 |
Mouais , j ai un doute avec 6Heures de courant pour 1 Litre d urine ...
Voici un petit calcul vite fais : dans 1L4 d urine il y a 25.5g d urée masse molaire de l urée : 60g par mol ca fait donc 25.5/60 = 0.425 mol d urée Dans chaque molecule il y a 4 Atomes d hydrogene donc : 4*0.425 = 1.7 mol d hydrogene soit 1.7 g d ' Hydrogene ( H: 1g/mol) Ca fait 18 Litre d Hydrogene ( H:0.08988g/litre) Pouvoir calorifique de l hydrogene : 12.75 KJ/litre Ca fait donc 229,5KJ C est a dire 63W pendant 1 heure ...(1J=1W/s) De quoi eclairer ses toilettes quoi ... Ya t il un chimiste dans cette salle pour confirmer mon calcul??? SG |
|
Ecrit le: Jeudi 21 Mars 2013 à 19h09

|
|
|
Expert(e)       Groupe: Membres Messages: 238 Membre n°: 10183 Inscrit le: 11/10/2012 |
pour ce qui est du volume sacregraal je pense qu'il ya un souci je ne suis pas calé en math mais au vu de ce que j'ai produit en quantité d'hydrogene avec moins d'un litre d'urine et ce qui rester ensuite dans l'electrolyseur j'avais encore vraiment du volume avec 2L5 d'hydrogene tiré
du coup je pense que 18L sa fait vraiment peu pour 1L A+ |
|
Ecrit le: Jeudi 21 Mars 2013 à 19h19

|
|||
 Expert(e)       Groupe: Membres Messages: 2064 Membre n°: 275 Inscrit le: 11/06/2007 |
Pour le volume de gaz extrait... L'hydrogène sort à la cathode. Mais il y a aussi de l'azote + traces d'hydrogène et d'oxygène, qui sortent à l'anode. http://www.rsc.org/chemistryworld/News/200...ly/02070902.asp ** Edit /
|
||
|
Ecrit le: Jeudi 21 Mars 2013 à 20h47

|
|
|
Expert(e)       Groupe: Membres Messages: 323 Membre n°: 10284 Inscrit le: 02/02/2013 |
De plus tout depend de la tension que tu utilise par cellulle car au dessus de 2 Volts , tu electrolyse l eau aussi ...
A mon avis il ne faut pas depasser 1,5V par cellulle pour electrolyser uniquement l urée ... SG |
|
Ecrit le: Vendredi 22 Mars 2013 à 10h35

|
|
 Expert(e)       Groupe: Membres Messages: 2064 Membre n°: 275 Inscrit le: 11/06/2007 |
J’y reviens sur la « batterie décalottée » des nigériennes… Si c’est le cas bien sur…
- Un élément de batterie conservé (2V). - Cinq éléments restants, transformés en cellule d’hydrolyse. Cellules alimentées en série, donc 2V / 5 = 0,4 V On ne peut pas faire mieux pour une tension légèrement supérieure à 0,37 V (seuil nécessaire pour l’hydrolyse de l’urée)… |
|
Ecrit le: Vendredi 22 Mars 2013 à 10h54

|
|
|
Expert(e)       Groupe: Membres Messages: 323 Membre n°: 10284 Inscrit le: 02/02/2013 |
Ca me parrais tres plosible ton hypothese Gegyx !
 SG |
|
Ecrit le: Vendredi 22 Mars 2013 à 12h43

|
|
|
Expert(e)       Groupe: Membres Messages: 238 Membre n°: 10183 Inscrit le: 11/10/2012 |
C'est bien pensé gegyx mais du coup l'amperage doit etre tres faible non?
|
|
Ecrit le: Samedi 23 Mars 2013 à 11h50

|
|
|
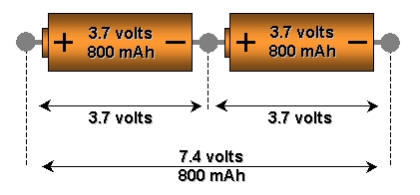
Expert(e)       Groupe: Membres Messages: 502 Membre n°: 10213 Inscrit le: 25/11/2012 |
Non! L'amperage reste le meme que la batterie. Une baterrie au plomb multicellulaire est l'équivalent de piles montées en série. Seul le voltage diminue, pas l'amperage
 |
|
Ecrit le: Samedi 23 Mars 2013 à 12h43

|
|
|
Expert(e)       Groupe: Membres Messages: 238 Membre n°: 10183 Inscrit le: 11/10/2012 |
Merci achenar je ne savais pas.
C'est donc le temps d'utilisation qui s'en trouve reduit ? |
|
Ecrit le: Samedi 06 Avril 2013 à 09h24

|
|
|
Expert(e)       Groupe: Membres Messages: 238 Membre n°: 10183 Inscrit le: 11/10/2012 |
salut a tous
le weekend dernier j'ai pu récupérer une batterie a mon boulot hs mais neuve je l'ai ouverte et j'ai garder les trois meilleurs éléments (1.5v par element) et au moment de" la recharger (j'avais acheter un chargeur 6V le mois dernier) j'ai fait une pitite bêtise Quand on prend une une batterie si on supprime des elements on inverse les polarités si on a un nombre impair d’élément. Et du coup j'ai branché mon chargeur a l'enver mon fusible a peter mais du coup je crois que j'ai endomager la batterie je me retrouve avec 4.5 sur trois elements je vais laisser tomber la batterie comme électrolyseur du coup ,c'est pas tres pratique . J'ai aussi du mal a trouver du mal a trouver une plaque de nickel vers chez moi pour l'inox 316 c'est bon mais dernièrement j'ai trouvé ce site/ http://www.goodfellow.com/fr/ Je ne sais pas ce qu'il vaut mais en tout cas ils vendent des plaque de nickel/chrome je viens d'apprendre que l'on pouvais acheter des carte bleue prépayée sans information personnelles dans les bureaux de tabac ce qui va etre très pratique pour me procurer le bon matos A+ |
|
Ecrit le: Samedi 06 Avril 2013 à 11h23

|
|
 Expert(e)       Groupe: Membres Messages: 2064 Membre n°: 275 Inscrit le: 11/06/2007 |
Bonjour,
Egalement je cherchais depuis un moment, où trouver une plaque de zinc. Etonné que cela ne soit plus courant. Maintenant les gouttières sont en alu et les vieilles sont récupérées par les pro pour les revendre au poids… C’est désolant. Je me suis dit qu’il existerait bien ce que l’on cherche dans des appareils obsolètes. A part des machin zingués, pas grand chose. Et puis je suis tombé sur cette vidéo rigolote, qui m’a fait honte (où je me suis senti un peu bête d'ailleurs)… Déjà ce Mike Gyver nous montre simplement comment faire une batterie de fortune Zinc-Cuivre de 1,5 V. Et là on se dit que les anciens connaissaient sûrement le mécanisme pour faire de la dorure. Mais à 0:30 secondes, le jack-pot pour dégoter du zinc. (=> carcasse de lecteur de disquette) https://www.youtube.com/watch?v=kY9vabnM-kg |
|
Ecrit le: Samedi 06 Avril 2013 à 13h45

|
|
|
Expert(e)       Groupe: Membres Messages: 238 Membre n°: 10183 Inscrit le: 11/10/2012 |
merci gegyx pour cette info
|
|
Ecrit le: Samedi 06 Avril 2013 à 18h38

|
|
|
Expert(e)       Groupe: Membres Messages: 502 Membre n°: 10213 Inscrit le: 25/11/2012 |
J'ai fait mes calculs, en mettant 2 transfo 9 v en serie on tombe sur du 0.368V, faut au moins qu'ils tiennent 20A pour une electrolyse efficace.
Du coup on redresse le courant avec un pont a diode sur le 220V (on perd 0.7v au passage), puis transfo de 9v et enfin transfo 9v. On a une sortie en 0.37v en 100Hz redressé. c'est le minimum, mais comme on a rarement du 220 dans nos prise, moi j'ai du240 par ex. , je tomberai à 0.4v. Ce qui laisse une petite marge de manoeuvre. Elle est pas belle la vie? |
|
Ecrit le: Dimanche 28 Avril 2013 à 02h09

|
|
|
Expert(e)       Groupe: Membres Messages: 109 Membre n°: 10103 Inscrit le: 25/04/2012 |
http://translate.google.fr/translate?hl=fr...lla:fr:official
Si y'en a qui aime les maux de tete http://etd.ohiolink.edu/send-pdf.cgi/Singh...ohiou1258349080 Si vous aimez depenser vos sous http://www.sciencedirect.com/science/artic...926337311002505 C'est peut etre ce doc => 233 pages http://etheses.whiterose.ac.uk/2129/1/Roll...ME_PhD_2011.pdf |
1 utilisateur(s) sur ce sujet (1 invités et 0 utilisateurs anonymes)
0 membres:
 Pages: (3) 1 [2] 3 Pages: (3) 1 [2] 3 |
   |
[ Script Execution time: 1.5023 ] [ 12 queries used ] [ GZIP activé ]




